 Aves Labs由Gary Ciment和Fazilah Adam于1995年共同创立,Aves Labs率先开发出新颖的算法来发现蛋白质中的高度免疫原性肽序列,针对鸡抗体的新型亲和纯化方法,并开发了许多其他有用的试剂,例如BlokHen®封闭剂和PrecipHen®免疫沉淀剂.
Aves Labs由Gary Ciment和Fazilah Adam于1995年共同创立,Aves Labs率先开发出新颖的算法来发现蛋白质中的高度免疫原性肽序列,针对鸡抗体的新型亲和纯化方法,并开发了许多其他有用的试剂,例如BlokHen®封闭剂和PrecipHen®免疫沉淀剂.
定制抗体亮点:领域特定的淀粉样前体蛋白(APP)抗体
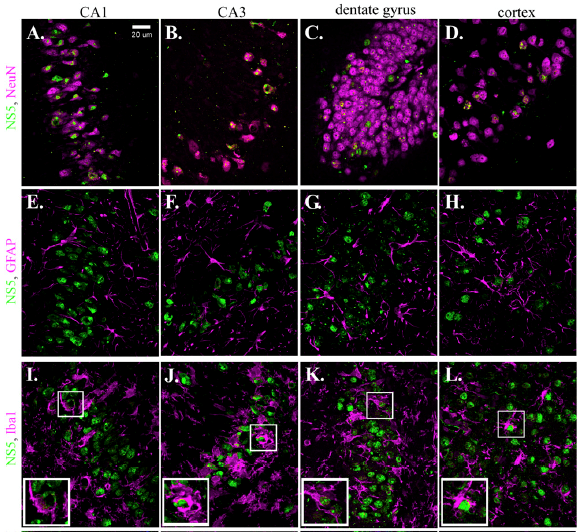
淀粉样前体蛋白(APP)是770个氨基酸的单程跨膜糖蛋白(图1)。众所周知,APP可以在脑组织和其他地方进行蛋白水解切割,从而产生两个重叠的肽,这与阿尔茨海默氏病的病因有关(Nunan和Small,2000; Selkoe,2000)。这两个肽被称为Ab1-40和Ab1-42(或-43),分别对应于残基672-711和672-713(或714),均位于G700的细胞外跨膜边界。
直到最近,APP相关研究的主要焦点一直可以理解为Ab肽域。这些肽被一组膜相关的蛋白酶(即分泌酶a和g)从APP上切割下来,产生自发聚集在细胞外的Ab肽。这些聚集体形成了独特的淀粉样蛋白斑块,在人脑活检和尸检切片中,这些淀粉样蛋白斑是阿尔茨海默氏病的病原学(Selkoe,2000; Hardy and Selkoe,2002)。

因此,APP的一个持久的奥秘涉及其余蛋白质的功能。当然,有很多理由认为APP不仅仅是导致这种毁灭性痴呆的原因。从昆虫到人类,APP在整个动物界都得到了广泛的表达和高度的保护(Coulson等,2000)。它在各种各样的胎儿组织中表达,在脑,肾,心脏和脾脏中的表达特别高(Weidemann et al。,1989)。此外,APP蛋白质内还有与其他蛋白质的已知功能域共享同源性的序列。例如,APP的细胞外E1和E2结构域与泛素基因产物内的功能域具有明显的序列同源性(Olsen和Lima,2013)。在这种情况下,这些区域被认为是肝素和金属结合域,并且是介导蛋白质-蛋白质相互作用的良好候选者。位于APP的E1和E2域之间的Kunitz(丝氨酸蛋白酶)抑制剂域提供了关于APP功能的另一种潜在见解。但是,APP内的该结构域不太可能抑制已知可产生Ab肽的a和g分泌酶,因为它们是非丝氨酸蛋白酶,并且不受Kunitz丝氨酸蛋白酶抑制剂的抑制。
其他各种研究表明,APP的非Ab区可能在神经系统修复中起作用。众所周知,脑外伤会导致人和小鼠APP的上调(Hortobagyi等,2007)。而且,APP的可溶性细胞外区域可以起到减轻脑外伤作用的作用(Thornton等,2006; Corrigan等,2012),提示了某种保护作用。大量研究表明,APP的E1和E2肝素和金属结合域参与了这种保护,尽管这种保护的机制尚不清楚(cf,Zhou等,2011)。
另一方面,APP的短细胞内结构域似乎也在脑形态发生中起作用(Klevanski等人,2015)。在这里,APP上非常保守的YENPTY序列(包含在Aves的cAPP抗体识别的肽中)似乎是神经肌肉连接和海马体正确形态发生所必需的。缺少YENPTY主题的基因敲除小鼠表现出肌肉无力,以及海马相关行为(如空间学习)的缺陷。
最后,在神经元迁移的无脊椎动物模型中,APP被发现在调节神经母细胞沿肠道运动的程度方面发挥了作用。这种调节似乎涉及APP中与异三聚体G蛋白Goa相互作用的细胞内结构域(Swanson等,2005; Ramaker等,2016; Ramaker and Copenhaver,2017)。在哺乳动物中,APP的可溶性细胞外片段以高特异性与另一种参与神经元迁移的蛋白质SorLA / LR11结合(Andersen等,2006)。
为了开发针对APP不同功能区域的抗体试剂,我们首先将人类APP序列(NCBI登录号NP_000475.1)插入我们专有的ImmunogenicityAlgorithm®中。从最初的30个候选序列中,选择了大约12个肽序列,确保我们覆盖了该基因产物的整个长度。由于技术原因,我们在该序列的N端添加了一个半胱氨酸和一个合成的间隔氨基酸,以提高缀合和亲和纯化的效率。然后在7周内将这些肽的KLH偶联物注射到蛋鸡的乳房肌肉中,并在第4次注射后收集卵。然后制备亲和纯化的抗体,并将其发送至各种合作者,以确定哪些抗体表现出有用的免疫组织化学信号。一旦鉴定出有用的抗体,我们就向用于制备初始抗体制剂的相同母鸡中进行额外注射,收集额外的卵,并进行额外的亲和纯化抗体。

总之,Aves Labs提供了多种针对APP基因产物内各种肽序列的特异性抗体,这些抗体可用于这种神秘蛋白的功能,其误加工可能导致毁灭性的人类疾病。
参考资料
Andersen,OM,Schmidt,V.,Spoelgen,R.,Gliemann,J.,Behlke,J.,Galatis,D.,McKinstry,WJ,Parker,MW,Masters,CL Hyman,BT,Cappai,R.,Willnow ,TE(2006)。 生化。45(8): 2618-2628。
Corrigan,F.,Vink,R.,Blumbergs PC,Masters,CL Cappai,R.,van den Heuvel,C.(2012年)。表征淀粉样前体蛋白的敲除对轻度脑外伤后预后的影响。 脑水库。1451: 87-99。
Coulson,EJ,Paliga,K.,Beyreuther,K.,Masters,CL(2000)。淀粉样蛋白前体超基因家族的进化告诉我们有关其功能的信息。 神经化学。国际36(3): 175-184。
Hardy,J.,Selkoe,DJ阿尔茨海默氏病的淀粉样假说:治疗方法的进展和问题。 科学 297(5580): 704-706。
Hortobagyi,T.,Wise,S.,Hunt,N.,Cary,N.,Djurovic,V.,Fegan-Earl,A.,Shorrock,K.,Rouse,D.,Al-Sarraj,S.,J Pathol 33(2): doi.org/10.1111/j.1365-2990.2006.00794.x
Klevanski,M.,Herrmann,U.,Wayer,SW,Fol,R.,Cartier,N.,Wolfer,DP,Cldwell,JH,Korte,M.,Müller,UD J.Neurosci。35(49): 16018-16033。
Nunan,J.,Small,DH(2000)。通过a,b和g分泌酶调节APP切割。 FEBS信函483: 6-10。
Olsen,SK,Lima,CD(2013)。泛素E1-E2复合物的结构:对E1-E2硫酯转移的见解。 Molec。细胞49(5): 884-896。
Ramaker,JM,Copenhaver,PF(2017年)。淀粉样蛋白前体蛋白家族作为非常规的Go-偶联受体和神经元运动的控制。 神经原。4(1): e1288510(12页)。
Ramaker,JM,Swanson,TL,Copenhaver,PF(2016)。Manduca contactin调节淀粉样前体蛋白依赖性神经元迁移。 J.神经科学。36(33): 8757-8775。
Selkoe,DJ(2000)。建立关于阿尔茨海默氏病的综合理论。假设:阿尔茨海默氏病是由淀粉样β蛋白的脑积聚和细胞毒性引起的。 安 纽约学院 科学 924: 17-25。
Swanson,TL,Knittel,LM,Coate,TM,Farley,SM,Snyder,MA,Copenhaver,PF(2005)。淀粉样蛋白前体蛋白的昆虫同源物在已识别的迁徙神经元群体中与异三聚体G蛋白果阿相互作用。 发展。生物学 288: 160-178。
Thornton,E.,Vink,R.,Blumbergs,PC,van den Heuvel,C.可溶性淀粉样蛋白前体蛋白α减轻了大鼠弥漫性脑损伤后的神经元损伤并改善了功能结局。 脑水库。1094(1): 38-46。
Weidemann,A.,Konig,G.,Bunke,D.,Fischer,P.,Slbaum,JM,Masters,CL,Beyreuther,K。(1989)。阿尔茨海默氏病A4淀粉样蛋白前体的鉴定,生物发生和定位。 细胞57(1): 115-126。
Zhou A.-D.,Chan,CH,Ma,QH,Xu,X.-H.,Xiao,Z.-C.,Tan,E.-K. (2011)。淀粉样蛋白前体蛋白(APP)在神经发生中的作用。 细胞粘附和迁移5(4): 280-292。